البنزين الفورمولا: أي من الاختلافات هو الصحيح؟
الهيدروكربونات العطرية لديها بنية دوري. الممثل الأول من هذه السلسلة هو البنزين (C6H6). اقترحت الصيغة التي تعكس هيكل المادة لأول مرة من قبل الكيميائي كيكول في عام 1865. وفقا للعالم، وقال انه يفكر في لغز من البنزين لفترة طويلة. ليلة واحدة كان يحلم ثعبان عض ذيله. في الصباح، تم تجميع الصيغة البنائية للبنزين بالفعل. كانت حلقة تتكون من 6 ذرات كربون. ثلاثة منهم كان مع اتصال مزدوج.

هيكل البنزين
الكربون في تكوين الهيدروكربونات العطريةتشكل مسدس منتظم. في بعض الأحيان، عند كتابة معادلات التفاعل، يتم رسمها في اتجاه عمودي. وقد تلقت هذه المجموعة من الذرات اسما خاصا - نواة البنزين. وتأكيد التركيب الدوري للبنزين هو إنتاجه من ثلاث جزيئات من الأسيتيلين - هيدروكربون غير مشبع مع رابطة ثلاثية. الهيدروكربونات العطرية هي أيضا غير المشبعة و تظهر بعض خصائص مميزة ألكنيس. لهذا السبب، في حلقة البنزين، ثلاثة شرطات موازية للوجوه تشير إلى رابطة مزدوجة. هذه الصيغة من البنزين لا تعكس تماما حالة ذرات الكربون في الجزيء.
البنزين: صيغة تعكس الهيكل الحقيقي
في الواقع، الرابطة بين الكربون في الحلبةتعادل بعضها البعض. من بينها، لم يكن من الممكن أن واحدة واحدة ومزدوجة. وتفسر هذه الميزة عن طريق الهيكل الإلكتروني للبنزين، الذي الكربون في النواة هو في سب2-الهجنة المختلطة، متصلة الجيرانعلى حلقة والهيدروجين بثلاث سندات واحدة المعتادة. في هذه الحالة، يظهر مسدس، الذي 6 ذرات الكربون و 6 ذرات الهيدروجين هي في طائرة واحدة. يتم ترتيب الغيوم الإلكترون فقط من الإلكترونات p الرابعة التي لا تشارك في التهجين بشكل مختلف. شكلها يشبه الدمبل، والمركز هو على متن الطائرة من الحلبة. والأجزاء سميكة على أعلى وأسفل. في هذه الحالة، فوق نواة البنزين وتحته، هناك نوعان من كثافة الإلكترون التي ظهرت عند الغيوم المتداخلة من P- الإلكترونات. هناك رابطة كيميائية عامة للكربون في الحلبة.
خصائص حلقة البنزين
نظرا لكثافة الإلكترون الكلي، والمسافة بين الكربون في الحلبة. وهي تساوي 0.14 نانومتر. إذا كان هناك روابط واحدة ومزدوجة في جوهر البنزين، سيكون هناك مؤشرين: 0.134 و 0.154 نانومتر. يجب أن لا تحتوي الصيغة البنيوية الحقيقية للبنزين على روابط بسيطة ومزدوجة. لذلك، تصنف الهيدروكربونات العطرية كمركبات عضوية غير مشبعة فقط بشكل رسمي. في تكوينها، فإنها تشبه ألكنيس، ولكنها يمكن أن تدخل ردود الفعل الاستبدال، وهو أمر نموذجي للهيدروكربونات في نهاية المطاف. جوهر العطرية من البنزين لديها مقاومة كبيرة للأكسدة. كل هذه الميزات تسمح لنا للنظر في الحلبة نوع خاص من الاتصال - وليس ضعف وليس واحد.

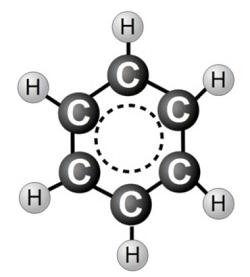
كيف تصور صيغة البنزين؟
صحيح هو صيغة البنزين ليس مع ثلاث روابط مزدوجة، كما هو الحال في كيكول، ولكن في شكل مسدس مع دائرة داخل. وهو يرمز إلى الانتماء المشترك من 6 الإلكترونات.
يؤكد تناظر الهيكل وخصائص المادة. حلقة البنزين مستقرة، لديها طاقة اقتران كبيرة. خصائص الممثل الأول من الهيدروكربونات العطرية تتجلى في مثيلاته. ويمكن تمثيل كل منها كمشتقات يتم فيها استبدال الهيدروجين لمختلف الجذور الهيدروكربونية.
</ p>







